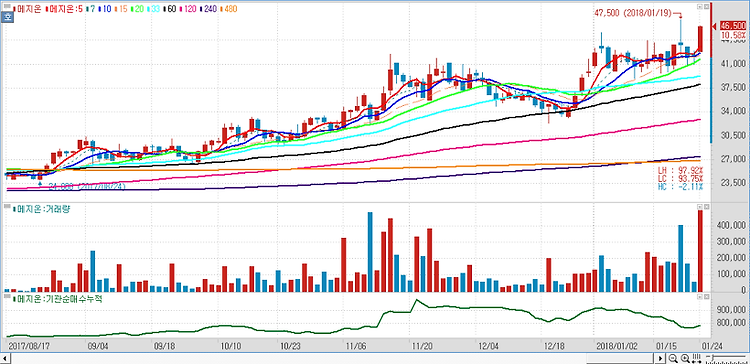
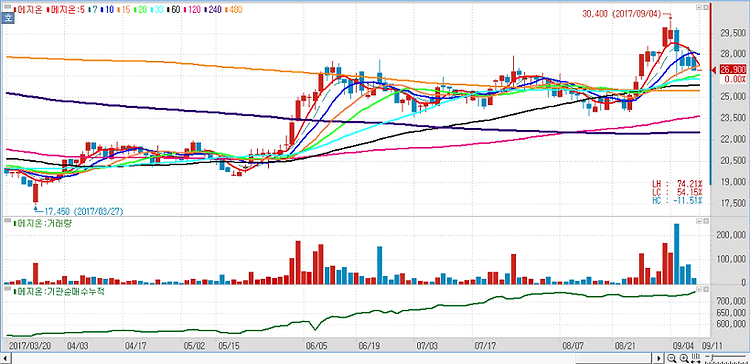
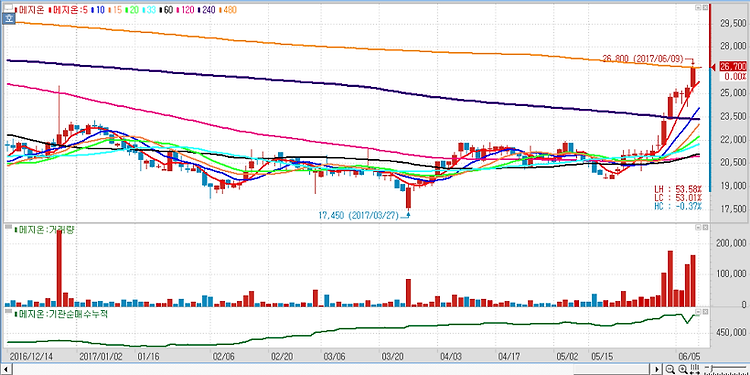
메지온(140410)에 대해 폰탄수술 치료제인 유데나필이 내년 임상 승인 및 출시가 기대된다. 메지온의 임상 3상은 총 400명 규모로 진행되며, 환자 모집은 마무리 단계인 것으로 파악된다. 추적관찰기간 6개월 및 통계 데이터 분석 1~2개월 소요를 감안하면 연말까진 톱라인 결과가 발표될 것으로 예상한다. 유데나필은 희귀의약품으로 지정됐기 때문에 패스트트랙(Fast Track) 적용으로 내년 승인 및 출시가 기대된다. 폰탄수술은 '단심실심장병'(SVHD·Single Ventricle Heart Disease) 에 대한 치료법이다. 미국 내 폰탄수술 환자 수는 약 3만명으로 알려져 있으며 연령대별 분포는 12세 미만 1만명, 12세 이상 19세 미만 1만명, 19세 이상 1만명으로 구성돼 있는 것으로 추산..