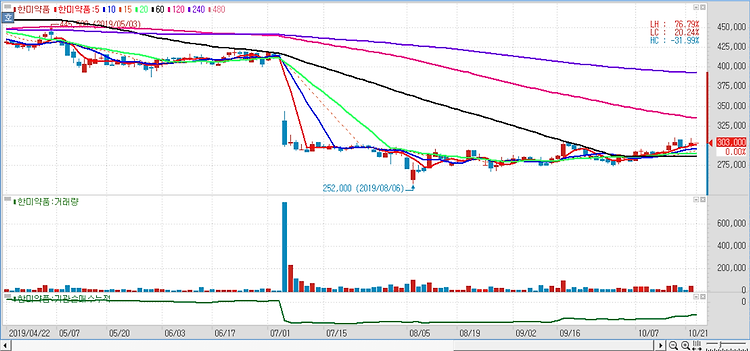
한미약품(128940)의 3분기 실적이 시장 예상치를 상회할 것이라고 평가했다. 한미약품의 3분기 매출액과 영업이익은 각각 2620억원, 220억원으로 전년 동기보다 11%, 3% 증가할 것이며 영업이익은 컨센서스 179억원을 23% 가량 상회할 것이다. 제넨텍의 계약금 유입이 올 4월 종료됐으나 고마진의 자체 제품인 아모잘탄, 로수젯, 에소메졸 등 국내 순환기 전문의약품 분야가 지속적으로 성장하고 있기 때문이다. 북경한미 매출액은 619억원, 영업이익은 103억원으로 전망된다. 얀센에 기술이전한 듀얼어고니스트의 기술 반환, 롤론티스(호중구감소증치료제) BLA(신약승인) 신청 이슈 등으로 연초 대비 주가가 33% 하락했는데 악재는 충분히 반영됐다는 평가다. 향후엔 안정적인 실적을 바탕으로 R&D 성과를 ..